TENSION SUPERFICIAL E INTERFACIAL: Definición, cómo se mide y algunas aplicaciones.
TENSION SUPERFICIAL E INTERFACIAL: Definición, cómo se mide y algunas aplicaciones.
La tensión superficial es cantidad de energía que se requiere para incrementar la superficie de un líquido por unidad de área. Esta energía se requiere dada la resistencia de los líquidos a aumentar su superficie.
La tensión superficial surge por las fuerzas de cohesión de las moléculas de los líquidos, que son distintas en la superficie y en el interior del líquido (figura 1).
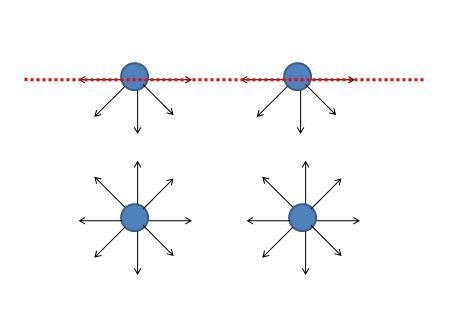
Las moléculas de la superficie tienen mayor energía, por lo que el sistema minimiza la energía total, reduciendo el número de partículas superficiales. Las moléculas de la superficie se ven como una membrana elástica como podemos ver en el siguiente vídeo.
Es de hacer notar que se denomina tensión superficial a la tensión superficial cuando el líquido está en contacto con el aire y tensión interfacial si se trata de dos líquidos inmiscibles.
La tensión interfacial se puede considerar como la tendencia de un líquido a reducir la superficie interfacial de tal manera que se minimice la energía superficial. En el caso de las gotas, la esfera es la forma a la que tienden.
Si dos fases no miscibles (o parcialmente miscibles) α y β se colocan juntas, aparecen tres regiones (figura 2).
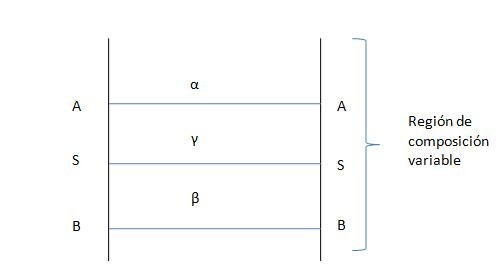
La composición de la nueva fase que denominaremos γ y que corresponde a la región interfacial vendrá descrita en términos del número de moles moles niγ del componente i contenidos en la región entre A y B, donde niγ es el número total de moles del componente i en la región entre A y B menos el número de moles de este componente i, que estarían dentro de esta región si las fases α y β se hubiesen extendido a una superficie de separación S sin cambiar las propiedades que tenían en el seno del líquido:
Por lo tanto, si el área de la superficie es A, se puede definir la concentración en exceso superficial (que es una medida de la acumulación de una especie en la interfase debido a la adsorción) como:
Γi puede ser positiva o negativa y sus unidades son mol/cm2.
La energía interna total de un sistema viene dada por:
Donde T= Temperatura
S= Entropía
P= Presión
V= Volumen
μi= Potencial químico
ni = Número total de moles
La energía interna de la fase interfacial será:
Los términos PV γ y σA tienen signos opuestos, ya que la presión tiende a expandir mientras la tensión interfacial tiende a contraer. La temperatura T, La presión P y el potencial químico μ i no requieren índice ya que tienen valores iguales para las tres fases α,β, y γ ya que el sistema está en equilibrio.
Diferenciando (3) tenemos que:
De la primera y segunda Leyes de la Termodinámica
para nuestro caso:
restando la ecuación (6) de la (4)
Por lo tanto, a temperatura y presión constante, se obtiene la ecuación de la tensión interfacial de Gibbs
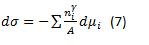 (7)
(7)La ecuación de Gibbs se puede simplificar para el caso de un surfactante distribuido entre dos fases suponiendo que una fase (orgánica) y la otra fase (acuosa) estén separadas por una superficie plana.
Método del peso de la gota
La tensión interfacial se mide por diversos métodos: Método de la elevación capilar, Método de la placa de Wilhelmy, Método de la gota pendiente, Método del anillo entre otros.
En este trabajo se escogió el método del peso de la gota ya que es un método bastante preciso y que no requiere grandes inversiones.
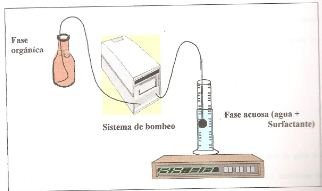
Las medidas se realizan inyectando lentamente a través de un capilar, gotas de un solvente orgánico (en este caso diclorometano) en el seno de otro líquido (en este caso surfactante y agua). La gota crecerá lentamente y se mantendrá adherida al capilar hasta que se rompa el equilibrio entre la tensión interfacial y el peso de la gota. La gota crece hasta que el peso la hace desprenderse del capilar.
Un esquema de un equipo básico se muestra en la figura 3. El mismo consta primordialmente de una bomba cromatográfica y una balanza de precisión.
El método del peso se basa en la ecuación de la tensión interfacial en función del peso de la gota, como se muestra en la figura 4.
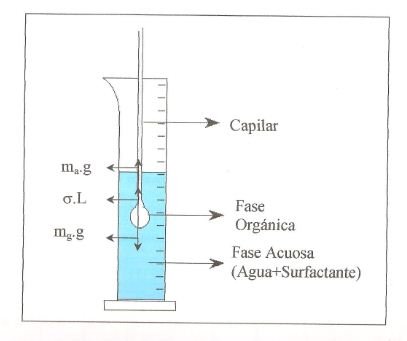
De ahí por el diagrama de fuerzas se deduce que mag +σL=mgg, de donde se deduce que
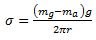 (9)
(9)A la ecuación (9) se le aplica un factor de corrección debido a que la gota no se desprende totalmente del extremo del capilar, así tenemos que:
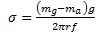 (10)
(10) Donde f = factor de corrección de Harkis y Brown
ma=masa del agua
mg= masa de la gota
r= radio interno del orificio del capilar
La tensión interfacial es medida unidades de energía por unidad de área (o en unidades de Fuerza por unidad de longitud).
El factor f es una constante y es llamado factor de corrección de Harkins y Brown (1), quienes encontraron experimentalmente que f es independiente de la naturaleza del líquido y del material y depende solamente del radio interno del capilar y del volumen de la gota, es decir f depende de la razón r/V1/3.
Aplicaciones:
La utilización de plásticos en nuestra época es cada vez mayor y cada vez se profundiza en el estudio de ellos. El Polivinilcloruro (PVC) es uno de los plásticos más usados: en botellas, tuberías, cables, juguetes, etc. Y obviamente sus diferentes aplicaciones requieren que sus propiedades (tamaño promedio de partículas, densidad aparente, porosidad) sean las deseadas en las que la tensión interfacial juega un papel muy importante.
Existen diversas variables que influyen en el tamaño de las gotas y la distribución de tamaños de partículas: geometría del sistema tanque/agitador, proporción de las fases inmiscibles usadas en la suspensión, velocidad de agitación, tensión interfacial líquido/líquido y la utilización de surfactantes. El tamaño de las gotas de una suspensión está dado por el balance entre el esfuerzo cortante dado por la agitación y la tensión interfacial entre las dos fases, siendo esta última la propiedad fisicoquímica que tiene mayor importancia en la determinación del tamaño de las gotas y por ende de determina la granulometría del PVC. Uno de los procesos mediante los cuales se produce PVC es mediante la polimerización en suspensión que consiste en poner en contacto dos fases inmiscibles en un recipiente agitado mecánicamente (figura 5).
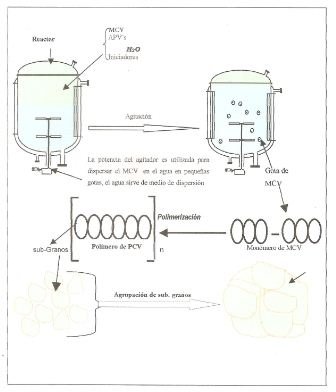
Aun cuando la intensión era evaluar la polimerización del PVC y como se afecta con los surfactantes que se indican posteriormente, dado que e l monómero Cloruro de Vinilo (MCV) es un gas cancerígeno a temperatura y presión ambiente, se sustituyó por un solvente orgánico clorado: diclorometano CH2CL2 que tiene propiedades similares al MCV.
Los surfactantes utilizados fueron: Eteres de Celulosa Methocel (F50,K100,A15),Alcoholes Polivinilicos APV (de 0H 72.5, 0H 80, 0H 88 y Copolímero de Acido Acrílico y 2 Etilhexilacrilato Ethapol 1000.
En (2) se concluyó:
los surfactantes de eteres de celulosa reducen la tensión interfacial mucho más que el acido acrílico.
La tensión interfacial presentó un comportamiento no lineal.
En (3) se concluyó:
La mezcla de alcoholes polivinilicos reducen más rápidamente la tensión interfacial que los alcoholes individualmente.
Estos resultados pudieron sugerir recomendaciones a los procesos de polimerización en suspensión del PVC para ser aplicados en la antigua INDESCA.
Figuras 1 y 2 son de elaboración propia, las figuras 3, 4 y 5 son tomadas de las referencias 2 y 3 en las que participé.
Referencias:
1) Yasuhiko H. Correction factor drop formation. AICHE J. Vol.36, No. 8 (1990)
2) Cabarca N. Trabajo Especial de Grado. FEC.LUZ. 2002.
3) Parra z. Trabajo Especial de Grado. FEC.LUZ. 2002.
4) Sears F. y Salinger G. Termodinámica, teoría cinética y termodinámica estadística. Editorial Reverte, s.a. 1978.
5) Billmayer F. Ciencia de los Polímeros. Editorial Reverte, s.a. 1978.
Mi muy hermosa colega @emily61, veo que ha avanzado mucho en el formateo de sus posts por lo que la felicito. Muy didáctico su post acerca de la Tensión Superficial, disfruté leerlo (me lo leí todito jajajaja). Votada y reestimeada!. Saludos.
Has sido un buen profesor. Gracias
Gracias mi muy hermosa colega @emily61. Siempre a la orden.
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Saludos @emily61. Excelente trabajo. Una presentación de primera. Gracias por compartirlo con nosotros.
Gracias mi estimado director, he aprendido un poquito de Uds. Saludos
Hola Chama Emily, tu trabajo me cayó del cielo, porque estoy estudiando la relación del Efecto Venturi y de la tensión superficial en plásticos que flotan en el agua. Esto es esencial para entender el porqué se forman la islas de plástico en el Pacífico y otros espacios marítimos...
Excelente...
YO
Me encanta esa pasión tanto tuya como de la chama Gabriela por el ambiente. Besos
Hola @emily61 esta bien tu post. Mas adelante sacare una aplicación general de la tensión superficial en la biología.
Gracias. Estaré pendiente. Saludos
Hi @emily61!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV